A peptidek olyan vegyületek osztálya, amelyeket több aminosav peptidkötéssel történő összekapcsolása képez. Mindenütt jelen vannak az élő szervezetekben. Eddig több tízezer peptidet találtak az élő szervezetekben. A peptidek fontos szerepet játszanak a különféle rendszerek, szervek, szövetek és sejtek funkcionális aktivitásának szabályozásában, valamint az élettevékenységekben, és gyakran használják a funkcionális elemzésben, az antitest kutatásban, a gyógyszerfejlesztésben és más területeken. A biotechnológia és a peptid -szintézis technológia fejlesztésével egyre több peptid gyógyszert fejlesztettek ki és alkalmaztak a klinikán.
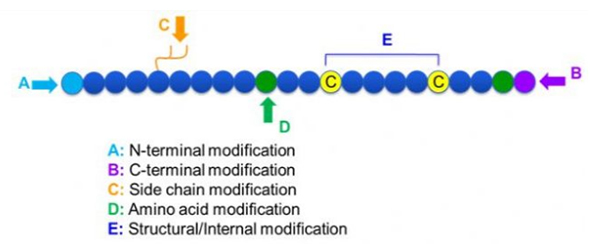
A peptid-módosítások széles választéka létezik, amelyek egyszerűen eloszthatók a Post módosításra és a folyamat módosítására (származtatott aminosav-módosítással) és az N-terminális módosításra, a C-terminális módosításra, az oldallánc-módosításra, az aminosav-módosításra, a csontváz módosítására stb., A módosítási helytől függően (1. ábra). Fontos eszközként a peptidláncok fő láncszerkezetének vagy oldalsó lánccsoportjainak megváltoztatásához, a peptid módosítása hatékonyan megváltoztathatja a peptidvegyületek fizikai és kémiai tulajdonságait, növeli a víz oldhatóságát, meghosszabbíthatja a cselekvési időt in vivo, megváltoztathatja biológiai eloszlását, kiküszöbölik az immunogenitást, csökkentik a mérgező mellékhatásokat stb.
1. ciklizáció
A ciklikus peptidek számos alkalmazásban vannak az orvosbiomedicinben, és a biológiai aktivitású természetes peptidek ciklikus peptidek. Mivel a ciklikus peptidek általában merevebbek, mint a lineáris peptidek, rendkívül rezisztensek az emésztőrendszerrel szemben, képesek maradni az emésztőrendszerben, és erősebb affinitást mutatnak a célreceptorokhoz. A ciklizáció a legegyszerűbb módszer a ciklikus peptidek szintetizálására, különösen a nagy szerkezeti csontvázú peptidek esetében. A ciklizációs mód szerint felosztható oldalsó láncoldali lánctípusra, terminál - oldallánc típusa, terminál - terminál típusa (vég -vég típusa).
(1) SideChain-SideChain
Az oldallánc-ciklizáció leggyakoribb típusa a ciszteinmaradékok közötti diszulfid áthidalása. Ezt a ciklizációt egy pár ciszteinmaradék vezetése vezeti be, amelyet diszulfidkötések kialakulása érdekében oxidálnak. A policiklusos szintézis a szulfhidriló -védelmi csoportok szelektív eltávolításával érhető el. A ciklizáció megtehető akár a disszociáció utáni oldószerben, akár egy pre-dissociation gyantán. A gyanták ciklizációja kevésbé hatékony lehet, mint az oldószer -ciklizáció, mivel a gyanták peptidei nem képeznek könnyen ciklikus konformációkat. Egy másik típusú oldallánc -oldallánc -ciklizáció az aszparaginsav vagy a glutaminsavmaradék és az alap aminosav közötti amidszerkezet kialakulása, amely megköveteli, hogy az oldallánc -védelmi csoportnak szelektíven eltávolítsák a polipeptidből a gyantán vagy a disszociáció után. Az oldallánc harmadik típusa-oldallánc-ciklizáció a difenil-éterek képződése tirozinnal vagy p-hidroxi-fenil-glicinnel. A természetes termékek ilyen típusú ciklizációja csak a mikrobiális termékekben található, és a ciklizációs termékek gyakran potenciális gyógyászati értéket mutatnak. Ezeknek a vegyületeknek az előkészítése egyedi reakciós körülményeket igényel, így ezeket gyakran nem használják a hagyományos peptidek szintézisében.

(2) Terminál és szintű
A terminális láncciklizáció általában magában foglalja a lizin vagy ornitin oldallánc amino-csoportjával, vagy az N-terminálral az aszparaginsavval vagy a glutaminsav oldalláncával. Más polipeptid ciklizációt úgy végeznek, hogy éterkötéseket képeznek a C terminális és a szerin vagy a treonin oldalláncok között.
(3) terminál vagy fej-farok típusa
A láncpolipeptidek oldószerben ciklusba kerülhetnek, vagy oldalláncciklációval rögzíthetők. A peptidek oligomerizációjának elkerülése érdekében alacsony peptidek koncentrációját kell alkalmazni az oldószer -központosításban. A fej-farok szintetikus gyűrűs polipeptid hozama a lánc polipeptid szekvenciájától függ. Ezért a ciklikus peptidek nagyméretű előkészítése előtt először létrehozni kell a lehetséges láncolt ólompeptidek könyvtárát, amelyet a ciklizáció követ, hogy a szekvenciát a legjobb eredményekkel megtalálja.
2. N-metilezés
Az N-metilezés eredetileg a természetes peptidekben fordul elő, és a peptidszintézisbe kerülnek, hogy megakadályozzák a hidrogénkötések képződését, ezáltal a peptidek rezisztensebbé válnak a biológiai lebontás és a clearance ellen. A peptidek N-metilezett aminosav-származékok alkalmazásával történő szintézise a legfontosabb módszer. Ezenkívül az N- (2-nitro-benzol-szulfonil-klorid) polipeptid-rezin-metanol-intermedierek Mitsunobu reakciója szintén alkalmazható. Ezt a módszert használták az N-metilezett aminosavakat tartalmazó ciklikus peptid könyvtárak előállítására.
3. foszforiláció
A foszforiláció a természetben az egyik leggyakoribb poszt-transzlációs módosítás. Az emberi sejtekben a fehérjék több mint 30% -a foszforilálódik. A foszforiláció, különösen a reverzibilis foszforiláció, fontos szerepet játszik számos sejtfolyamat, például szignál -transzdukció, gén expresszió, sejtciklus és citoszkeleton szabályozás, valamint apoptózis szabályozásában.
A foszforiláció különféle aminosavmaradékokon megfigyelhető, de a leggyakoribb foszforilációs célok a szerin, a treonin és a tirozinmaradékok. A foszfotirozin, a foszfotreonin és a foszfozerin -származékok peptidekbe vezethetők a szintézis során, vagy peptid -szintézis után képződhetnek. Szelektív foszforiláció érhető el szerin, treonin és tirozin maradékaival, amelyek szelektíven eltávolítják a védőcsoportokat. Egyes foszforilációs reagensek a foszforsav -csoportokat is bevezethetik a polipeptidbe a poszt módosítással. Az utóbbi években a lizin helyspecifikus foszforilációját kémiailag szelektív Staudinger-foszfit reakcióval sikerült elérni (3. ábra).

4. Myrisztoiláció és palmitoiláció
Az N-terminális zsírsavakkal történő acilezése lehetővé teszi a peptidek vagy fehérjék kötődését a sejtmembránokhoz. Az N-terminális miridamoilezett szekvencia lehetővé teszi az SRC családi protein-kinázok és a reverz transzkriptáz GAQ fehérjék számára, hogy a sejtmembránokhoz kötődjenek. A mirisztikus savat a gyanta-polipeptid N-terminálisához kapcsolódottunk standard kapcsolási reakciók felhasználásával, és a kapott lipopeptid standard körülmények között elkülöníthető és RP-HPLC-vel tisztítható.
5. glikoziláció
A glikopeptidek, például a vankomicin és a teicolanin fontos antibiotikumok a gyógyszer-rezisztens bakteriális fertőzések kezelésében, és más glikopeptideket gyakran használnak az immunrendszer stimulálására. Ezenkívül, mivel sok mikrobiális antigén glikozilezett, nagy jelentőséggel bír a glikopeptidek vizsgálata a fertőzés terápiás hatásának javításában. Másrészt kiderült, hogy a tumorsejtek sejtmembránján lévő fehérjék rendellenes glikozilezést mutatnak, ami a glikopeptidek fontos szerepet játszik a rák és a tumor immunvédelmi kutatásában. A glikopeptideket FMOC/T-Bu módszerrel állítják elő. A glikozilezett maradékokat, például a treonint és a szerin, gyakran pentafluor -fenol -észter aktivált FMOC -val bevezetik a polipeptidekbe a glikozilezett aminosavak védelme érdekében.
6. izoprén
Az izopentadieniláció a C-terminális közelében lévő oldallánc ciszteinmaradékain fordul elő. A protein-izoprén javíthatja a sejtmembrán affinitását és kialakíthatja a protein-protein kölcsönhatást. Az izopentadienált fehérjék közé tartozik a tirozin -foszfatáz, a kis GTáz, a cochaperone molekulák, a nukleáris rétegek és a centromer kötő fehérjék. Az izoprén -polipeptideket izoprén felhasználásával lehet előállítani gyantákon vagy cisztein -származékok bevezetésével.
7. polietilén -glikol (PEG) módosítás
A PEG módosítása felhasználható a fehérje hidrolitikus stabilitásának, a biológiai eloszlásnak és a peptid oldhatóságának javítására. A PEG -láncok peptidekbe történő bevezetése javíthatja farmakológiai tulajdonságaikat, és gátolhatja a peptidek hidrolízisének proteolitikus enzimek általi hidrolízisét. A PEG -peptidek könnyebben áthaladnak a glomeruláris kapilláris keresztmetszeten, mint a szokásos peptidek, ami nagymértékben csökkenti a vese clearance -t. A PEG peptidek in vivo kiterjesztett aktív felezési ideje miatt a normál kezelési szint alacsonyabb dózisokkal és ritkábban gyakori peptid gyógyszerekkel fenntartható. A PEG módosításának azonban negatív hatásai is vannak. A nagy mennyiségű PEG megakadályozza az enzimet a peptid lebontásában, és csökkenti a peptid kötődését a célreceptorhoz. A PEG peptidek alacsony affinitását azonban általában ellensúlyozza a hosszabb farmakokinetikai felezési idő, és azáltal, hogy hosszabb ideig jelen vannak a testben, a PEG-peptidek nagyobb valószínűséggel tudják felszívni a célszövetekbe. Ezért a PEG polimer specifikációit optimális eredmények elérése érdekében optimalizálni kell. Másrészt a PEG peptidek felhalmozódnak a májban a redukciós vese clearance miatt, ami makromolekuláris szindrómát eredményez. Ezért a PEG módosításait alaposabban kell megtervezni, ha peptideket használnak a gyógyszervizsgálathoz.

A PEG módosítók általános módosítási csoportjai nagyjából összefoglalhatók az alábbiak szerint: amino (-aMIN) -NH2, aminometil -CH2 -NH2, Hydroxy -OH, karboxi -cooh, szulfhidril (-thiol) -sh, maleimid -mal, szukinimid -karbonát -karbonát -Scinimide -acetát -szkennelés, szuperimid -prómozók, szamár -spaimid, Scrinimide -Scrinimide -SPAIMIDE -SPAIMID. N-hidroxizukcinimid-NHS, akrilát-ch2ch2cooh, aldehid-co (például propion-ald, butirald), akril bázis (-krilát-acrl-acrl-acril-acril-acrilát-hidrazid, alkyn, alkyn, alkyn, alkyn, alkyn, alkyn, alkyn, alkyd P -toluenszulfonát -tootok, szukcinimid szukcinát -SS stb. A karbonsavakkal ellátott PEG -származékok az N -terminális aminokhoz vagy a lizin oldalláncokhoz kapcsolhatók. Az amino-aktivált PEG csatlakoztatható az aszparaginsavhoz vagy a glutaminsav oldalláncához. A MAL-aktivált PEG konjugálható a teljesen elnyert cisztein oldalláncok merkaptánjával [11]. A PEG módosítókat általában az alábbiak szerint osztályozzák (MEGJEGYZÉS: Az MPEG metoxi-PEG, CH3O- (CH2CH2O) N-CH2CH2-OH):
(1) Egyenes lánc PEG módosító
MPEG-SC, MPEG-SCM, MPEG-SPA, MPEG-OTS, MPEG-SH, MPEG-ALD, MPEG-Butyrald, MPEG-SS
(2) bifunkciós PEG módosító
HCOO-PEG-COOH, NH2-PEG-NH2, OH-PEG-COOH, OH-PEG-NH2, HCL · NH2-PEG-COOH, MAL-PEG-NHS
(3) elágazó PEG módosító
(MPEG) 2-NHS, (MPEG) 2-ADD, (MPEG) 2-NH2, (MPEG) 2-MAL
8. Biotinizáció
A biotin erősen köthető az avidinnel vagy a streptavidinnel, és a kötési szilárdság még a kovalens kötéshez is közel áll. A biotinnal jelölt peptideket általában immunoassay, hisztocitokémia és fluoreszcencia-alapú áramlási citometriában használják. A jelölt antibiotin antitestek felhasználhatók a biotinilezett peptidek kötésére is. A biotin címkék gyakran a lizin oldallánchoz vagy az N terminálhoz vannak rögzítve. A 6-aminokaproinsavat gyakran használják a peptidek és a biotin közötti kötésként. A kötés rugalmas a szubsztráthoz való kötődésben, és szterikus akadályok jelenlétében jobban kötődik.
9. Fluoreszkáló címkézés
A fluoreszcens jelölés felhasználható az élő sejtekben a polipeptidek nyomon követésére, valamint az enzimek és a hatásmechanizmusok vizsgálatára. A triptofán (TRP) fluoreszcens, így felhasználható a belső címkézéshez. A triptofán emissziós spektruma a perifériás környezettől függ, és csökken az oldószer polaritásának csökkenésével, egy olyan tulajdonsággal, amely hasznos a peptidszerkezet és a receptor kötődésének kimutatására. A triptofán fluoreszcenciát protonált aszparaginsavval és glutaminsavval lehet leállítani, ami korlátozhatja annak használatát. A dansyl -kloridcsoport (Dansyl) nagyon fluoreszkáló, ha egy amino -csoporthoz kötődik, és gyakran használják fluoreszcens jelölőként aminosavak vagy fehérjék számára.
A fluoreszcencia rezonancia energiakonverzió (FRET) hasznos az enzimvizsgálatokhoz. FRET alkalmazásakor a szubsztrát polipeptid általában fluoreszcencia-jelölőcsoportot és fluoreszcencia-oltócsoportot tartalmaz. A jelölt fluoreszcens csoportokat az oltó nem foton energiaátvitel útján oltja le. Amikor a peptid elkülönül a kérdéses enzimtől, a címkézési csoport fluoreszcenciát bocsát ki.
10. ketrec polipeptidek
A ketrecpeptidek optikailag eltávolítható védőcsoportokkal rendelkeznek, amelyek megóvják a peptidet a receptorhoz való kötődéstől. Az UV sugárzásnak kitettség esetén a peptid aktiválódik, helyreállítva a affinitását a receptorhoz. Mivel ezt az optikai aktivációt idő, amplitúdó vagy hely szerint lehet szabályozni, a ketrecpeptidek felhasználhatók a sejtekben bekövetkező reakciók vizsgálatára. A ketrec polipeptidek leggyakrabban használt védőcsoportjai a 2-nitrobenzilcsoportok és azok származékai, amelyeket a peptid szintézisben be lehet vezetni védő aminosavszármazékok révén. A kifejlesztett aminosavszármazékok a lizin, a cisztein, a szerin és a tirozin. Az aszfartát és a glutamát -származékokat azonban nem használják általában a peptid szintézis és disszociáció során a ciklizációra való hajlamuk miatt.
11. poliantigén peptid (térkép)
A rövid peptidek általában nem immunizálódnak, és az antitestek előállításához be kell kapcsolni a hordozófehérjékkel. A poliantigén peptid (MAP) több azonos peptidből áll, amelyek a lizinmagokhoz kapcsolódnak, amelyek kifejezetten képesek nagy hatékonyságú immunogéneket expresszálni, és felhasználhatók a peptid-hordozó fehérje párok előállítására. A MAP polipeptideit szilárd fázis -szintézissel lehet szintetizálni a MAP gyantán. A hiányos csatlakoztatás azonban néhány ágon hiányzó vagy csonkított peptidláncokat eredményez, így nem mutatja az eredeti MAP polipeptid tulajdonságait. Alternatív megoldásként a peptidek külön -külön elkészíthetők és tisztíthatók, majd a térképhez csatlakoztathatók. A peptidmaghoz rögzített peptidszekvencia jól definiált, és könnyen jellemezhető tömegspektrometriával.
Következtetés
A peptid módosítása a peptidek tervezésének fontos eszköze. A kémiailag módosított peptidek nemcsak fenntarthatják a magas biológiai aktivitást, hanem hatékonyan elkerülhetik az immunogenitás és a toxicitás hátrányait is. Ugyanakkor a kémiai módosítás néhány új kiváló tulajdonsággal adhat peptideket. Az utóbbi években gyorsan fejlődtek a c-H aktiválásának módszere a polipeptidek poszt-módosítására, és számos fontos eredményt sikerült elérni.
A postai idő: 2025-07-03
