Segons la forma de connexió de l'aminoàcid i el sucre, el pèptid de sucre es pot dividir en quatre categories: glicosilació O, glicosilació C a N, sacarificació de rosada i connexió GPI (glicofosfatidlyinositol).
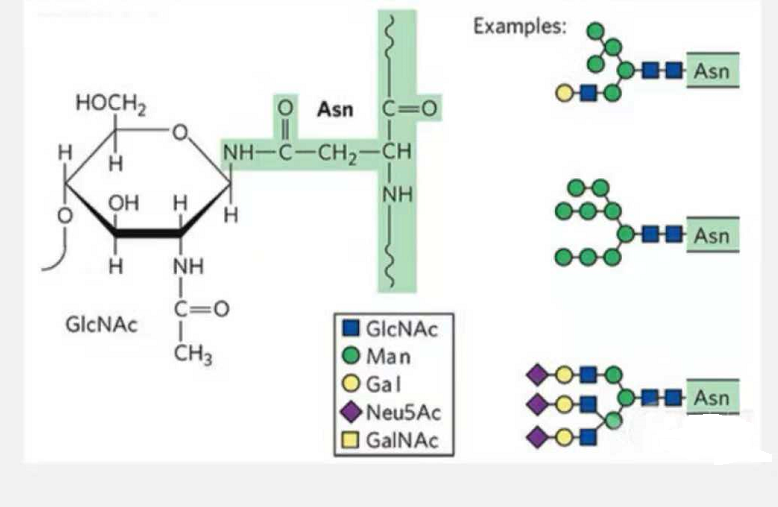
1. Els glicopèptids de N-glicosilació estan formats per N-acetamida glucosa a l'extrem reductor de la cadena de glicans (Glc-Nac) unida a l'àtom N del grup amida de la cadena lateral d'algun Asn de la cadena peptídica, i l'Asn capaç d'enllaçar la cadena de glicans s'ha de localitzar a l'AsN-X-Ser /Thr (X! =P) en el motiu format pels residus.El sucre és N-acetilglucosamina.
Glicopèptid estructural modificat per N-glicosilació
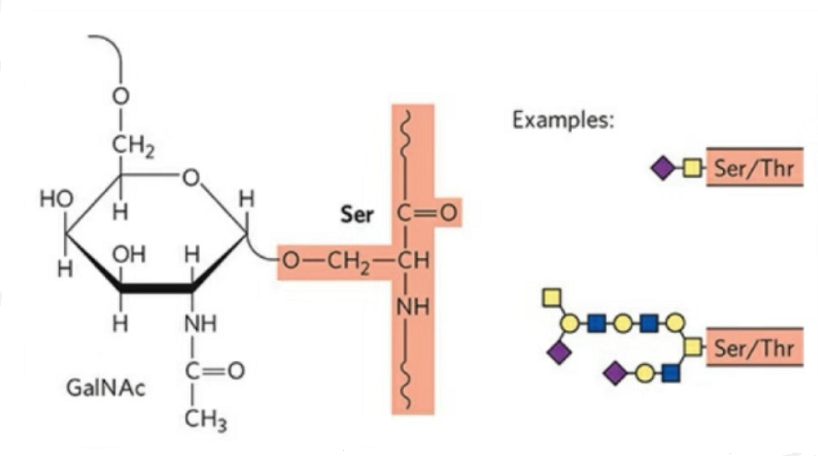
2. L'estructura de la O-glicosilació és més senzilla que la de la N-glicosilació.Aquest glicopèptid és generalment més curt que el glicà, però té més tipus que la N-glicosilació.Ser i Thr generalment es poden glicosilar a la cadena peptídica.A més, hi ha glicopèptids decorats amb glicosilació de tirosina, hidroxil i hidroxiprolina.La posició de l'enllaç és l'àtom d'oxigen hidroxil a la cadena lateral del residu.Els sucres enllaçats són galactosa o N-acetilgalactosamina (Gal&GalNAc) o glucosa/glucosamina (Glc/GlcNAc), manosa/manosamina (Man/ManNAc), etc.
La O-glicosilació modifica l'estructura
3. Glicosilació del glicopèptid O-GlcNAC ((N-acetilcisteïna (NAC)) (glcnAcN-acetilglucosamina/acetilglucosamina)
Una única glicosilació de N-acetilglucosamina (GlcNAc) connecta les proteïnes O-GlcNAc amb l'àtom d'oxigen hidroxil del residu de serina o treonina d'una proteïna.La glicosilació O-GlcNA és un ornament de monosacàrids O-GlcNAc sense extensió de glicà;Igual que la fosforilació de pèptids, la glicosilació O-GlcNAc de glicopèptids també és un procés de decoració de proteïnes dinàmica.La decoració anormal d'O-GlcNAc pot causar una varietat de malalties com ara diabetis, malalties cardiovasculars, tumors, malaltia d'Alzheimer, etc.
Punts de glicosilació dels glicopèptids
Les estructures bàsiques dels polipèptids i les cadenes de sucre estan unides a les cadenes de proteïnes mitjançant enllaços covalents, i els llocs que uneixen les cadenes de sucre s'anomenen llocs de glicosilació.Com que no hi ha cap plantilla per seguir la biosíntesi de les cadenes de sucre glicopèptid, s'uniran diferents cadenes de sucre al mateix lloc de glicosilació, donant lloc a l'anomenada inhomogeneïtat microscòpica.
Glicosilació de glicopèptids
1. Efecte de la glicosilació de glicopèptids sobre l'eficàcia de la teràpia de proteïnes terapèutiques
En el cas de les proteïnes terapèutiques terapèutiques, la glicosilació també afecta la vida mitjana i l'orientació dels fàrmacs proteics in vivo
2. Glicosilació de glicopèptids solubles i proteïnes
Els estudis han demostrat que les cadenes de sucre a la superfície de les proteïnes poden millorar la solubilitat molecular de les proteïnes
3. Glicosilació de glicopèptids i immunogenicitat de proteïnes
D'una banda, les cadenes de sucre a la superfície de les proteïnes poden induir respostes immunitàries específiques.D'altra banda, les cadenes de sucre poden cobrir determinades superfícies de la superfície de la proteïna i reduir-ne la immunogenicitat
4. Glicosilació de glicopèptids que augmenta l'estabilitat de proteïnes
La glicosilació pot augmentar l'estabilitat de les proteïnes a diverses condicions de desnaturalització (com desnaturalitzants, calor, etc.) i evitar l'agregació de proteïnes.Al mateix temps, les cadenes de sucre a la superfície de les proteïnes també poden cobrir alguns punts de degradació proteolítica de les molècules de proteïnes, augmentant així la resistència de les proteïnes a les proteïnases.
5. Glicosilació de glicopèptids que afecta l'activitat biològica de les molècules proteiques
El canvi de glicosilació de proteïnes també pot permetre que les molècules de proteïnes formin noves activitats biològiques
Hora de publicació: 03-agost-2023